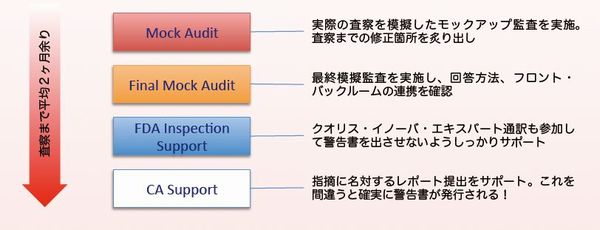
FDA査察対応
Step1 Mock Audit
実際のFDA査察を想定したモック監査を実施します。これはすでにクオリス・イノーバのプロジェクトを実施したお客様に対して有効です。(プロジェクトを行っていないお客様にはショックと焦りしか残らないかもしれません。)回答方法などの訓練やチーム連携も確認します。
Step2 Final Mock Audit
Step1 で洗い出された問題点を改善し、回答訓練、チーム連携を終えた後、本番さながらのモック監査を実施し最終チェックを行います。
Step3 FDA Inspection Support
実際のFDA査察には、私どもも参加し名刺を査察官に渡して、品質コンサルタントがいますよと言うメッセージを伝えます。同時に誤訳が無いよう訓練された私どもの専門ネイティブ通訳と連携し、査察がスムーズに、コミュニケーションエラーが発生しないように進め、結果的に指摘がある場合でも最悪の状況( 警告書の発行 )を回避するアクションをとります。
Step4 CA Support
指摘 Form481(オブザベーションレポート)が発行されると、査察後改善処置の計画を立て、20日営業日以内に FDA に報告(アクションレター)します。この報告書の内容に不備がある場合、警告書が出さてしまうため、アクションレターの内容をサポートし、警告書が発行されないよう指摘をクローズさせます。
査察を想定した査察対応プロジェクトについてはこちらをご覧下さい!
![]()









